合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
-
> 水和乙二醇-水混合體系中的離子液體-陽離子表面活性劑混合膠束自聚焦-電導法 表面張立法和光譜研究法—
> 克服表面張力使液態金屬可拉伸電子器件化的研究進展
> 表面張力的形成同處在液體表面薄層內的分子的特殊受力狀態密切相關。下列現象,與表面張力無關的是:
> 露珠為什么是球形的?這是液體的表面張力造成的!
> 酯功能化的雙子表面活性劑與血紅蛋白的結合——摘要、簡介
> 水面上單分子層膜通過磷脂光控開關實現可逆光學控制:結果和討論、結論
> 氟化石墨烯復合鍍層制備,如何減小電極和鍍液之間的界面張力
> ?白酒掛杯與表面張力有何關系
> 表面張力儀分子所受到的各個方向的力是相同的
> 座滴法測量玻璃熔體表面張力的影響因素研究
膜蛋白純化解決方案
來源:優寧維生物 瀏覽 539 次 發布時間:2022-09-14
膜蛋白是一種位于細胞膜上的蛋白,主要分為外周膜蛋白和跨膜蛋白兩大類。膜蛋白具有重要的生物功能,如控制能量轉換、參與信號轉導、控制物質運輸、維持細胞和組織結構等,因此膜蛋白一直是研究熱門,是當前近70%的藥物靶標。
想要研究更具體膜蛋白結構或者功能特性,我們首先要提取純化相應的膜蛋白。接下來以一篇經典Nature文章為例,解析如何提取純化膜蛋白。
2019年Nature文章:人的T cell receptor–CD3復合體結構研究
純化思路:
(1)重組蛋白的構建:
以哺乳細胞HEK293F為表達宿主,在C末端依次加了Strep和His標簽。
目的基因:TCRα,TCRβ(pCAG)+CD3γ、δ、ε、ζ(pcDNA3,4)。
(2)重組蛋白的誘導表達:
在37℃、含有5%CO2條件下,120 rpm培養60 h。
(3)細胞膜結構的制備和溶解:
通過離心收集細胞,然后勻漿破碎。
細胞膜結構組份的收集:用25 mM HEPES,pH 7.5,1 M NaCl緩沖溶液重懸,加入1mM PMSF,100,000g超速離心30 min收集細胞膜結構組份。
細胞膜結構的溶解:用25 mM HEPES,pH 7.5,150 mMNaCl,1%DDM,0.2%cholesteryl hemisuccinate tris salt,1 mM PMSF,4℃條件下溶解2 h。
40,000g離心30 min,收集上清,即為可溶的膜蛋白粗溶液。
(4)親和層析純化:
本文作者用StrepTactin填料進行純化。
結合條件:4℃結合3 h;
Wash buffer:25 mM HEPES,pH 7.5,300 mM NaCl,0.06%digitonin;
Elution buffer:25 mM HEPES,pH 7.5,150 mM NaCl,0.06%digitonin+4 mM desthiobiotin
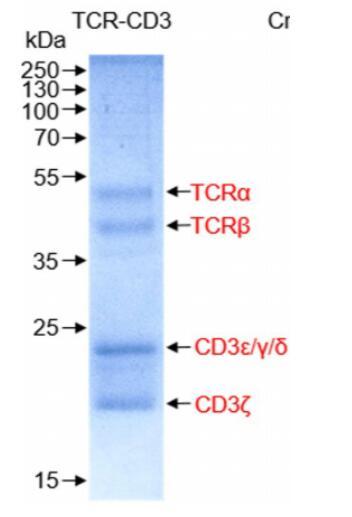
圖1親和層析后,各個亞基的SDS-PAGE圖
(5)膜蛋白復合體交聯
蛋白質濃縮后用0.1%(v/v)的戊二醛交聯40min,得到膜蛋白復合體。
(6)凝膠過濾分子篩層析:
用Superose 6 increase 10/300,buffer為25 mM HEPES,pH 7.5,150 mM NaCl,0.06%digitonin

圖2 TCR-CD3復合體SDS-PAGE圖
膜蛋白復合體TCR-CD3交聯后進行凝膠過濾分子篩層析,進行SDS-PAGE實驗,發現得到比較純的復合體。
(7)TCR-CD3結構分析
通過冷凍電鏡分析,TCR–CD3復合物的最終原子模型包含全長TCRαβ的亞基,完整的ECD和跨膜螺旋CD3γε,CD3δε和CD3ζζ
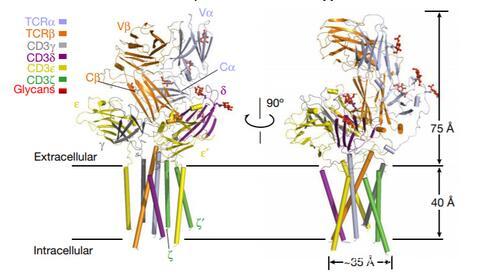
圖3 TCR–CD3復合體結構圖
看完大佬的實驗框架,是不是頓時對自己的實驗也有了一些思路?
總結一下,膜蛋白的一般研究流程:
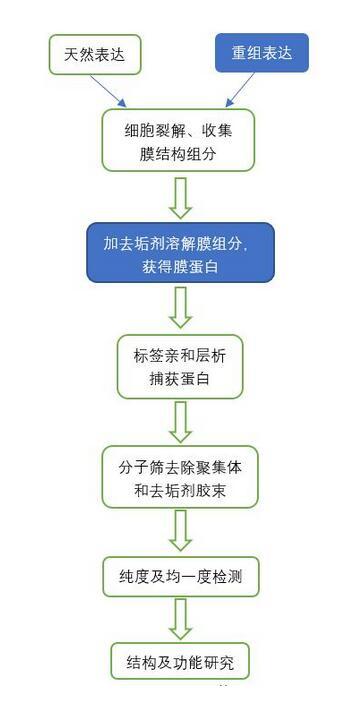
藍色背景分別是表達系統與去垢劑的選擇,是整個流程中至關重要的步驟。
膜蛋白的表達系統:原核表達(大腸桿菌、紅桿菌屬)、哺乳細胞(HEK293F)、酵母表達、昆蟲細胞表達。不同的表達系統的優缺點見下圖。

去垢劑的選擇:去垢劑別名表面活性劑、乳化劑、肥皂等等,分為離子型、非離子型和兩性離子型三類。去垢劑是同時具有親水性和疏水性基團的雙極性分子,能夠使磷脂雙分子層解體并釋放膜蛋白,并且為去膜狀態下的膜蛋白提供穩定的疏水環境。去垢劑也需要篩選合適的種類和濃度,各自優缺點見下圖。
蛋白純化:使用親和+凝膠過濾(分子篩)即可完成膜蛋白的純化流程。膜蛋白純化由于含有去垢劑的存在,離子交換不作為第一選擇。

操作TIPS
一、膜蛋白分離
1、膜蛋白的內源表達通常來說是比較低的,如果要提高產量可以通過重組膜蛋白的過表達,可以選擇大腸桿菌,酵母,哺乳動物或者無細胞表達體系。然而,外源表達的翻譯后修飾例如糖基化,磷酸化和乙酰化和天然蛋白的不同可能會導致重組蛋白的某些活性下降(原核表達沒有翻譯后修飾系統),可以考慮通過對組成修飾的氨基酸進行位點突變來改善。
2、跨膜蛋白具有較高的疏水性,經常需要高濃度的去垢劑來幫助溶解。此外,膜蛋白也溶液形成聚集體,甚至是在去垢劑存在的情況下,會影響下游純化效率。去垢劑的選擇也會影響下游純化步驟的效率。例如,在帶有電荷的去垢劑存在的情況下不適合使用離子交換層析;而在有去垢劑的情況下也不適合使用疏水層析。
3、一旦溶解之后,膜蛋白經常會變得更易于被蛋白酶降解。因此添加蛋白酶抑制劑例如EDTA和PMSF是很重要的(如果下游使用普通Ni柱純化,不能使用EDTA)。
二、外周膜蛋白提取
外周膜蛋白可以使用相對溫和的技術來分離,破壞外周膜蛋白和細胞膜之間的靜電作用或者氫鍵,而不破壞整個細胞膜。通常使用的試劑參見表一。使用含有高鹽離子濃度的緩沖液進行提取很有用因為他們會降低膜蛋白和帶有電荷的脂質之間的靜電相互作用。
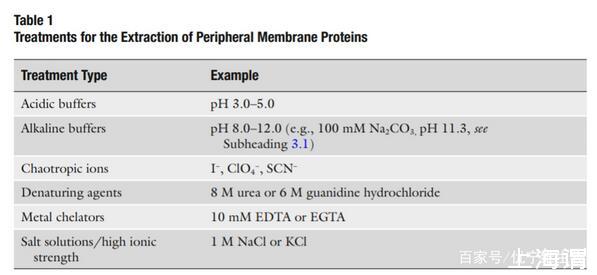
在提取緩沖液提取10-30min后,剩下的膜雙層結構和相關的膜內蛋白可以被離心分離(30-60min,100,000xg),釋放的外周膜蛋白存在于上清液中。
三、跨膜蛋白的提取
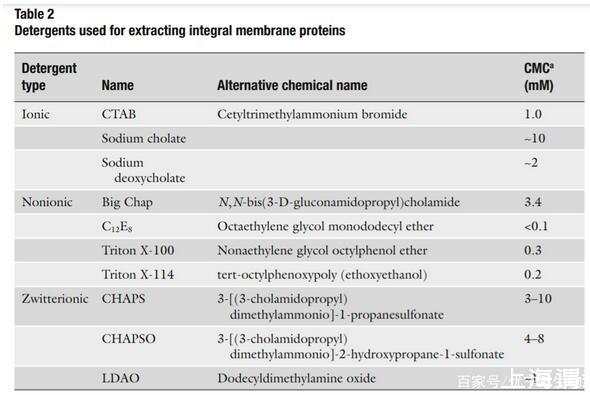
為了溶解得到跨膜蛋白,破壞膜雙層結構是必要的。通常使用去垢劑的方法。去垢劑是一種兩性分子,同時包含疏水和親水的部分,并且在水中會形成膠束。膠束是去垢劑親水頭向外,疏水頭向內排列的聚集體形式。去垢劑溶解蛋白通過一端結合蛋白的疏水部分,另一端結合親水部分。去垢劑的選擇應該足夠溶解膜蛋白而不會造成不可逆的變性。常見的去垢劑見表二。
當篩選去垢劑時,要注意每個去垢劑的臨界膠束濃度(CMC)。CMC是指自由的去垢劑分子形成膠束結構需要的濃度。因為溶液相當于膜蛋白從細胞膜上去除進入去垢劑膠束,所以CMC是蛋白提取所需的最低濃度。CMC值可參考表二。
四、去垢劑的篩選
為保證膜蛋白的溶解效率,需要對去垢劑類型及濃度進行篩選:
去垢劑篩選條件建議
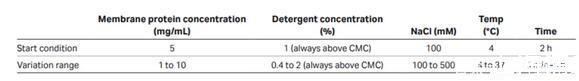
一般使用PBS或Tris buffer進行去垢劑篩選
DDM常用作初始嘗試的去垢劑
CHAPS和digitonin被證明在畢赤酵母體系中的細胞膜溶解具有較好的效果
可以考慮多種去垢劑混合使用
一些脂質、小的兩性物質(如1,2,3-庚三醇)或目標蛋白的一些已知配體可以提升膜的溶解效率
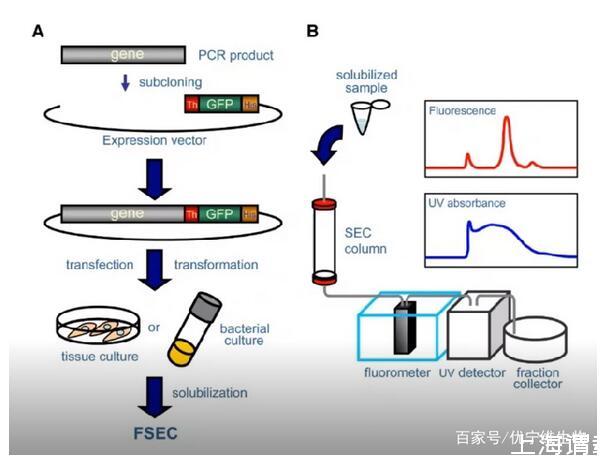
五、去垢劑快速篩選
FSEC用于表達條件和去垢劑的快速篩選。FSEC(Fluorescence-Detection Size-Exclusion Chromatography),又叫熒光檢測尺寸排阻色譜法。具體方法是將目的基因構建在帶有GFP標簽的融合表達載體上,進行小量表達。通過不同的去垢劑溶解后,然后上樣微量色譜柱,使用AKTA系統的紫外,熒光檢測器進行檢測(熒光檢測器需搭配)。由于目的蛋白帶有GFP標簽,使用熒光檢測會顯示出熒光信號。通過峰型和峰面積我們可以檢測到蛋白表達和溶解情況。