合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
應用不同組裝的磷脂酰膽堿對牛精漿蛋白的隔離——結果與討論
來源:上海謂載 瀏覽 791 次 發布時間:2021-10-20
三、結果
3.1. 精漿的界面特性
精漿 SDS-PAGE 電泳顯示 存在一系列 14 至 120 kDa 的多肽 具有不同的比例(圖 1),與之前的研究結果一致 [37]。 14 至 5 個主要頻段的比例 在泳道 4 上估計為 30 kDa。
在大約 16–17 kDa(74% 強度)。 它們被歸因于 BSP1 和 BSP3 [12]。 在約 28 kDa (9%) 處檢測到第二條帶 對應于 BSP5 [12]。 BSP1、BSP3 和 BSP5 的集合代表了精液中所含最小多肽的 83%。 血漿(在整個提取物中約占 65% [17])。 另一個樂隊是 檢測到 22 kDa (4%) 和一個在 14 kDa (13%) 對應于 一種核糖核酸酶 [22]。
通過跟蹤精漿水溶液的表面張力來突出這些組分的表面活性 (圖 2)與濃度(Gibbs 膜)。 的表面張力 新鮮樣品被證明相對較低 (47 mN/m) 并且增加了 因為樣品被稀釋了。 表面張力值等于純緩沖液-空氣界面的值 (72 mN/m)。 1/100000 的大稀釋。 因此,精漿顯示出顯著的表面活性:首先,新鮮樣品的表面張力 (47 mN/m) 與眾所周知的表面活性蛋白(如牛血清白蛋白 [38] 或溶菌酶)獲得的值一樣低 [39]其次,表面活性仍然存在于大范圍內 濃度范圍(需要稀釋 100,000 以去除 它)。 除此之外,還分析了表面膜的穩定性 通過執行朗繆爾薄膜在空氣 - 緩沖界面處。 薄膜的壓縮等溫線(圖 3)顯示出顯著增加 分兩步從 0 到 35 mN/m 的壓力。在 18.9 mN/m 時,有 是與空氣-緩沖液界面處分子構象變化有關的斜坡破裂。 壓縮能力 膜在升高的壓力下(大約與生物膜相關的壓力,25 mN/m)顯示出膜的高穩定性 由血漿精液成分形成。
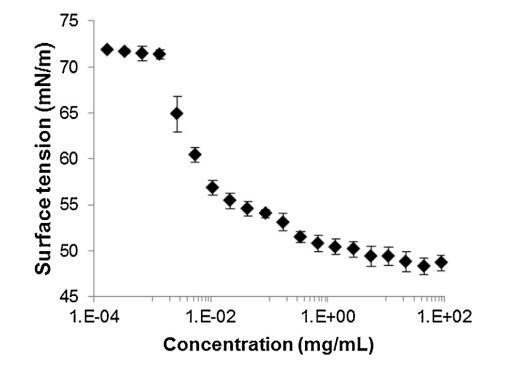
圖 2 牛氣水界面表面張力(±標準差) 精漿溶液中所含蛋白質濃度的函數 提取并以對數刻度表示 (T = 23.2 ?C ± 0.3 ?C, n = 2, 4 次重復 每個樣品)。
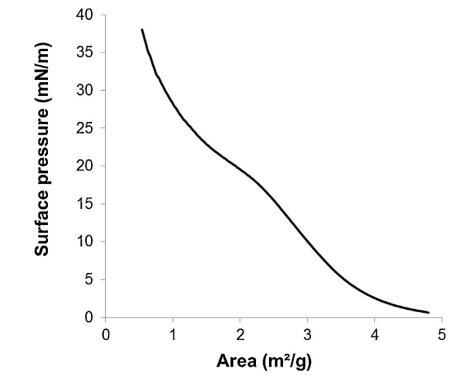
圖 3. 表面壓力-面積 (?-A) 等溫線形成于 通過傳播精漿形成空氣/緩沖液界面(n = 3,標準偏差 在 0-18.9 mN/m 范圍內不超過 1.5 mN/m,在 1.2 mN/m 范圍內不超過 18.9–38 mN/m)。
3.2. 低密度脂蛋白和脂質體對仿生外傳單的作用 精子膜
低密度脂蛋白和脂質體引入亞相的影響 精子膜仿生外葉的示意圖 在圖 4. 對于控制測量(沒有注入任何保護劑,設計為圖 4 中的 M),表面積略有下降 隨著時間的推移。 當低密度脂蛋白被注射到低于 重建的外葉(圖 4 中的 M/LDL 曲線),它導致了 表面積的快速和大量增加。 相比之下,注入 脂質體(圖 4 中的曲線 M/C4)幾乎沒有改變薄膜壓力 單層與參考單層的比較(曲線 米)。 脂質從脂質體中摻入的動力學 單層比低密度脂蛋白要慢得多。 因此,有一個弱 在時間尺度上脂質體在空氣-水界面的吸附 對應于精液的制備。
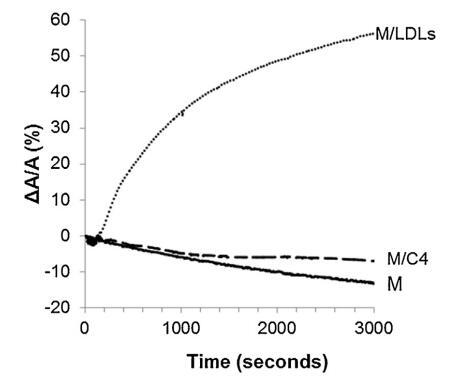
圖 4. 被覆蓋的界面的相對表面積隨時間變化 單層 (M) 以 25 mN/m 壓縮并在含有 (——) 沒有額外的分子,(...) LDL(4.6 毫克 PC)和(—)脂質體 C4(含有 4.8 毫克 PC)。 空氣-緩沖液界面的溫度為 34°C。
在低密度脂蛋白的情況下,注射的磷脂酰膽堿的量 根據低密度脂蛋白的組成,估計為 4.6 毫克 [33]。 在脂質體的情況下,分散體含有 6.55 ± 0.02 mg 脂質,即 4.8 毫克磷脂酰膽堿。 大幅增加 在重建的外層下注射低密度脂蛋白后的表面積 精子膜的小葉可能與精子的能力有關 低密度脂蛋白在空氣-水界面處自發吸附和擴散 [33]。 界面處低密度脂蛋白的容易破壞可能會釋放 具有表面活性的磷脂和蛋白質以及不溶的甘油三酯 [33]。 在脂質體的情況下,平衡 雙層形成磷脂和單層形成磷脂之間 磷脂取決于鏈不飽和度、鏈長和 極性頭基 [40]。 考慮雞蛋的主要成分 卵磷脂 (PC 74%) 及其脂肪酸組成 [41],有 大約 48% 的飽和 PC 和 52% 的不飽和 PC。在這項工作的溫度下,飽和 PC 沒有熔化,可能不會 在界面處擴散,而不飽和的則遠遠超過 它們的熔化溫度并可能擴散。 在剩余部分 PE (11%) 中,雙層和單層形成之間的平衡 磷脂與磷脂的結構密切相關 所以不能給他們下結論。 因此,不存在 基本解釋。 雞蛋脂質體缺乏吸附可能 可以解釋為它們的傳播以前已經 在自由界面上檢查:單層已經存在于 界面可能會限制基于磷脂的脂質體的擴散 在其他地方被認為是散裝的高穩定性物體, 特別是當由磷脂酰膽堿組成時。
3.3. 通過低密度脂蛋白隔離精漿成分和 脂質體
當牛精漿 (SP) 被注射到 單層,分子面積的變化在一個 時間的函數(圖 5 中的曲線 M/SP)。 表面積沒有立即增加,而是在 150 秒后才增加,因為 脂質的界面。 它在 150 秒內達到最大值(300 秒后 注入)然后它穩定了 300 秒并隨著時間的推移緩慢下降 (圖5)。 表面積的快速增加揭示了良好的表面 SP 成分的活性(最有可能是蛋白質),如圖所示 在圖中。 2 和 3. 600 秒后表面積的減少為 與純單層的速度相同。 因此,BSP 蛋白 吸附后留在界面上。
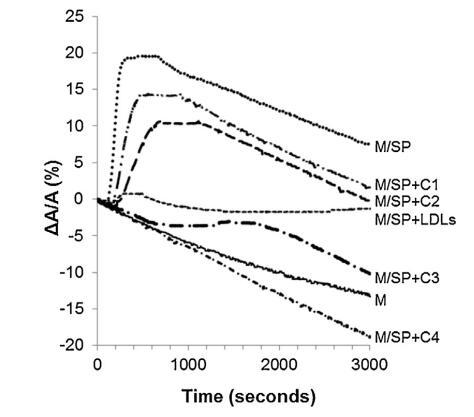
圖 5. 被覆蓋的界面的相對表面積隨時間變化 單層 (M) 并在包含 (——) 的緩沖液上形成,沒有額外的分子, 注射 (. . .) SP(26.6 ± 1.5 mg 蛋白質)后,SP(26.6 ± 1.5 mg 蛋白質)和不同濃度的脂質體 (— · · —) C1, (— —) C2, (- · —) C3 和 (- · -) C4(分別為 1.17 ± 0.02 mg、2.18 ± 0.02 mg、4.37 ± 0.02 mg 和 6.55 ± 0.02 毫克脂質)和 (- - -) 低密度脂蛋白(4.6 毫克 PC)和 SP 的混合物 (26.6 ± 1.5 毫克蛋白質)。 空氣-緩沖液界面的溫度為 34°C。 這 表面壓力保持在 25 mN/m。
當低密度脂蛋白與牛精漿混合時 蛋白質重量比為 10:1 (BSP:LDLs) 并注射到單層下方,單層的分子面積隨時間記錄 幾乎沒有變化(曲線 M/SP + LDL,圖 5)。 肩膀出現在 大約 400 s 揭示了 BSP 蛋白的弱吸附(這 肩部代表 M/SP 的 5%,上圖曲線)。 然后,該 1000s后分子面積的變化減少并穩定。 不會像 M 和 M/SP 曲線的變化那樣減少, 表明 LDLs 成分的吸附,與 它們在界面處的高擴散能力(曲線 M/LDL,圖 4)。 因此,SP 中所含 BSP 蛋白在界面處的吸附 由于低密度脂蛋白而大大降低,并且 BSP/低密度脂蛋白的比率非常高 接近最佳值以完全防止 BSP 蛋白質影響單層。 磷脂酰膽堿注射量 根據低密度脂蛋白的組成估計為 4.61 毫克 [33]。 因此,注射了 4.61 mg LDLs 的磷脂酰膽堿 26.6mg精漿蛋白質,即1mg精漿蛋白質需要0.17mg磷脂酰膽堿。
脂質體(不同濃度)對 BSP 的作用 蛋白質也顯示在圖5中。 脂質體被引入 在進入亞相之前與精漿接觸。 隨著脂質體中濃度的增加(曲線 M/SP + C1 到 C4), BSP 吸附引起的表面積增加 蛋白質逐漸延遲和減少。當量 達到 4.37 mg (C3),仍有少量 BSP 界面處的蛋白質,由 1600 秒的肩部證明。 在 最高濃度 (C4),未摻入 BSP 蛋白 觀察到,分子面積的變化甚至比對照曲線更負,表明 亞相中的膜組分。 因此,脂質體作用于 BSP 蛋白與 LDL 的作用方式相同。 最有趣的比例似乎介于 C3 和 C4 之間。 它是從 建立面積變化之間相互作用的曲線 和作為脂質體注射的磷脂質量(圖 6)。 這 注入 26.6 mg BSP 的最佳質量為 4.6 mg,即 PC:BSP 比率為 0.16 (w/w)。
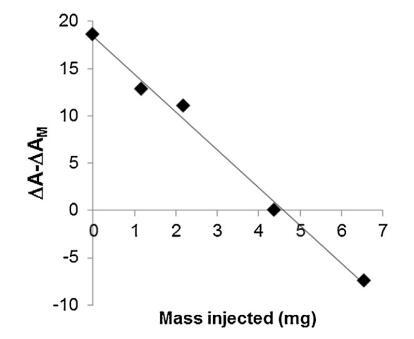
圖 6. 相對面積隨注射脂質體質量的變化 進入亞相。 線性回歸是通過 R2 為 0.992 獲得的。
3.4. 脂質體作用的顯微鏡評價 精漿
通過透射電子顯微鏡 (TEM) 檢查脂質體或 LDL 與含有 BSP 蛋白的 SP 的混合物 并與對照進行比較。 對應的圖片 無論放大倍數如何,精漿都沒有表現出結構(圖S1)。 相反,與低密度脂蛋白相關的結構 和脂質體很容易通過 (i) LDL 的致密和相當圓形的形狀 (圖 7A) 和 (ii) 圓形和有時 脂質體的多層結構(圖 7B)。 在......的存在下 精漿,整組圖像分析仍顯示 圓形物體。 它們的大小平均與分析的相似 沒有螯合劑(圖S2)。 然而,在幾個地方 在SP存在的情況下,一些大的圓形物體表征 通過(i)被厚層包圍的原生結構(圖7C) 低密度脂蛋白)或(ii)圓環內的致密核心(圖 7D 與 觀察到脂質體和圖 S3)。 與圖 7B 相比, 與精漿混合的脂質體系統地出現 比天然脂質體密度更大的核心。 這些新結構可能是由于滲透而導致膜破裂的結果。 BSP 蛋白進入界面層,導致 TEM 對比。

圖 7. (A) LDLs、(B) 脂質體、(C) LDLs 和精漿(精漿中的比例為 0.17 mg PC/mg BSP 蛋白)和 (D) 脂質體和精漿的冷凍 TEM 圖像 (精漿中 0.16 mg PC 脂質體/mg BSP 蛋白的比率)。
四、討論
4.1. BSP 蛋白的表面特性及其可能 生物學作用
張力測定結果表明精漿中含有表面活性成分。 這些最有可能 蛋白質,因為它們構成了精漿的主要部分。 他們 由一系列親水性和疏水性的 域 [5] 賦予它們兩親特性。 考慮到生物學背景,我們可以假設 BSP 蛋白可以 由于它們與 PC 的相互作用和它們自身的表面活性,到達被磷脂覆蓋的界面。 這可以解釋為什么 這個過程很快 [42]。將肽或蛋白質插入到 磷脂單層通常在流體域中進行 比壓縮域更可壓縮 [43]。 在 34°C,流體域由縮醛磷脂和不飽和磷脂酰膽堿組成 [35]。 因此,BSP 蛋白可以輕松穿透這些流體域,在那里它們可以立即相互作用 根據前面提到的涉及疏水腔的機制,使用含磷酸膽堿的分子 [11,12,34,42,44–46]。 BSP吸附量可能有限 通過流體域的可壓縮性。 總而言之,BSP 蛋白一旦被吸附,就會保持錨定在界面上,這要歸功于 它們的表面特性(我們的工作),構象重排 [47] 及其與膜成分的強相互作用 [48]。
4.2. 脂質體和低密度脂蛋白在 BSP 隔離中的效率 蛋白質
我們的結果表明脂質體與 LDL 一樣有效 防止 BSP 蛋白到達界面,提供 使用正確比率的脂質體/BSP。 對于低密度脂蛋白,我們的模型表明 BSP/LDL 的比率 (10:1 w/w),常用于冷凍保存 非常接近完全阻止 BSP 蛋白的最佳值 從影響單層。 PC/BSP 與 PC 組織的比率 低密度脂蛋白中的 0.17 毫克磷脂酰膽堿對應 1 毫克精漿蛋白質。 同樣,脂質體的最佳比例 PC/BSP 是 0.16 mg 磷脂酰膽堿用于 1 mg 精漿蛋白質。 知道雞蛋中 PC 的比例可能取決于喂養, 低密度脂蛋白中 PC 的比例可能因批次而異,因此這些 比率被認為是相等的。 該比率與 LDL 或脂質體的隔離結構無關的事實表明 來自 LDL 的載脂蛋白不與 BSP 結合,盡管這 綁定是可能的 [26,49]。 更引人注目的是,這個結果表明 PC 組裝為 LDL 中的單層或脂質體中的雙層都沒有影響。 在低密度脂蛋白的情況下,磷脂 占據外單層,所有這些都可以被 蛋白質。 相反,只有外葉的磷脂 形成單層脂質體的雙層實際上是直接 與 BSP 蛋白接觸。 由于絡合比相同 脂質體和低密度脂蛋白,以及 PC 分子 (74%) 也構成內部 雙層的小葉,這些小葉也參與 BSP 蛋白的復合。 符合BSP的輕松插入 蛋白質進入疏水膜,這些可以遷移 朝向內部小葉并引起一些破裂/融合 通過 TEM 觀察到脂質體的雙層。 盡管如此變化 低密度脂蛋白和脂質體的結構在 樣品和 BSP 蛋白可以被認為主要錨定在 低密度脂蛋白和脂質體的表面。 在更高的脂質體:BSP 比率 與這里研究的相比,BSP1 是 BSP 中的主要蛋白質 家族誘導脂質囊泡的伸長和形成 向小囊泡進化的珠子項鏈狀結構或 線狀結構[50]。










